Atom dan molekul
Atom
Atom merupakan bagian terkecil dari unsur. Atom bersifat tidak
bermuatan (netral). Setiap unsur terdiri dari sejenis atom, artinya
bahwa atom-atom unsur yang sama mempunyai sifat yang sama. Oleh sebab
itu, atom unsur diberi lambang yang sama dengan lambang unsurnya.
Jadi, atom nitrogen diberi lambang N dan atom karbon dengan lambang C. Atom unsur yang satu berbeda dengan atom unsur yang lainnya. Perbedaan itu dapat diibaratkan bahwa butir-butir jagung tidak sama dengan butir-butir beras.
Jadi, atom nitrogen diberi lambang N dan atom karbon dengan lambang C. Atom unsur yang satu berbeda dengan atom unsur yang lainnya. Perbedaan itu dapat diibaratkan bahwa butir-butir jagung tidak sama dengan butir-butir beras.
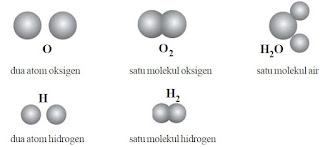
Molekul
Atom-atom memiliki kecenderungan stabil dengan cara mengikat atom lain yang sama atau tidak sama. Molekul yang terdiri dari atom-atom yang sama kita sebut molekul unsur, sedangkan yang terdiri dari atom-atom yang berbeda disebut molekul senyawa.
Contoh:
- molekul unsur : molekul O2, molekul H2, molekul N2, molekul Cl2.
- molekul senyawa : molekul air (H2O); molekul gula (C6H12O6); molekul garam dapur NaCl
Elektron dapat terikat
pada inti atom melalui gaya tarik
menarik Coulomb. Suatu sistem berelektron banyak yang terikat pada inti
atom disebut sebagai atom. Jika jumlah elektron berbeda dari muatan
listrik inti, atom tersebut dinamakan sebagai ion. Perilaku elektron
terikat yang seperti gelombang dideskripsikan menggunakan fungsi
matematika yang disebut orbital atom.
Tiap-tiap orbital atom memiliki satu set bilangan kuantumnya sendiri,
yaitu energi, momentum sudut, dan proyeksi momentum sudut. Menurut asas
pengecualian Pauli, tiap orbital hanya dapat diduduki oleh dua elektron,
yang harus berbeda dalam bilangan kuantum spinnya.
Elektron dapat berpindah dari satu orbital ke orbital lainnya melalui
emisi ataupun absorpsi foton yang energinya sesuai dengan perbedaan
potensial antar orbital. Metode perpindahan orbital lainnya meliputi pertumbukan dengan partikel elektron lain dan efek Auger.
Agar dapat melepaskan diri dari atom, energi elektron haruslah
ditingkatkan melebihi energi pengikatannya. Ini terjadi pada efek
fotolistrik, di mana foton yang berenergi lebih tinggi dari energi
ionisasi atom diserap oleh elektron.
Momentum sudut orbital elektron terkuantisasi. Oleh karena elektron
bermuatan, ia menghasilkan momen magnetik orbital yang proposional
terhadap momentum sudut. Keseluruhan momen magnetik sebuah atom adalah
setera dengan jumlah vektor momen magnetik orbital dan momen magnetik
spin keseluruhan elektron dan inti atom. Namun, momen magnetik inti
sangatlah kecil dan dapat diabaikan jika dibandingkan dengan elektron.
Momen magnetik dari dua elektron yang menduduki orbital yang sama
(disebut elektron berpasangan) akan saling meniadakan.
Ikatan
kimia antaratom terjadi sebagai akibat dari interaksi elektromagnetik,
sebagaimana yang dijelaskan oleh hukum mekanika kuantum. Ikatan yang
terkuat terbentuk melalui perkongsian elektron maupun transfer elektron
di antara atom-atom, mengizinkan terbentuknya molekul. Dalam molekul,
pegerakan elektron dipengaruhi oleh beberapa inti atom dan elektron
menduduki orbital molekul, sama halnya dengan elektron yang menduduki
orbital atom pada atom bebas.
Faktor mendasar pada struktur molekul adalah keberadaan pasangan elektron.
Kedua elektron yang berpasangan memiliki spin yang berlawanan,
mengizinkan keduanya menduduki orbital molekul yang sama tanpa melanggar
asas pengecualian Pauli. Orbital-orbital molekul yang berbeda memiliki
distribusi spasial rapatan elektron yang berbeda pula. Sebagai
contohnya, pada elektron berpasangan yang terlibat dalam ikatan,
elektron dapat ditemukan dengan probabilitas yang tinggi disekitar
daerah inti atom tertentu yang sempit, manakala pada elektron
berpasangan yang tidak terlibat dalam ikatan, ia dapat terdistribusi
pada ruang yang luas di sekitar inti atom.
Penjelasan Lengkap Energi Terbarukan
Penjelasan Lengkap Elektron (Penemuan elektron,Teori atom,Mekanika kuantum, dll)
Cepat dan Tepat Mendaftar Google Adsense Full